结石研究(28):肠源性高草酸尿症的病理生理学和治疗
- 民间偏方
- 2022-05-14
- 385
Clin J Am Soc .2021 Mar 8;16(3):487-495.
doi: 10.2215/CJN..Epub 2020 Sep 8.
and of
,Craig B ,Dean , A Baum4, ,Dawn ,Greg , , , West9,Felix ,John C
PMID:
PMCID:
DOI:10.2215/CJN.
肠源性高草酸尿症的病理生理学和治疗
肠源性高草酸尿症是一种独特的疾病,可能由多种促进脂肪吸收不良的胃肠道疾病引起。这反过来又会导致饮食中草酸盐的过度吸收和尿中草酸盐的排泄增加。高草酸尿会增加肾结石的风险,在更严重的情况下,还会增加 CKD 甚至肾功能衰竭。近几十年来,肠道高草酸尿症的患病率有所增加,这主要是因为越来越多地使用吸收不良减肥手术治疗医学上复杂的肥胖症。这篇对肠道高草酸尿症的系统评价是作为肾脏健康倡议赞助项目的一部分完成的,该项目描述了肠道高草酸尿症的病理生理学、原因、结果和治疗方法。目前的治疗选择仅限于纠正潜在的胃肠道疾病,强化饮食调整,并使用钙盐结合肠道中的草酸盐。目前缺乏这些治疗对临床显着结果(包括肾结石事件或 CKD)的影响的证据。因此,需要进一步研究以更好地确定影响不良后果风险的精确因素、现有治疗策略的长期疗效,并开发新的治疗方法。
高草酸尿是形成草酸钙肾结石(以下简称结石)的重要致病因素,这是人类最常见的类型。显着的高草酸尿症可能是由于肝脏过度生产(原发性高草酸尿症)的遗传原因,或通过导致脂肪吸收不良和胃肠道中草酸盐吸收增加的胃肠道(GI)疾病(肠道高草酸尿症)。原发性高草酸尿症和肠道高草酸尿症不仅与结石形成有关,而且可能进展为晶体肾病、CKD 和肾衰竭。针对这两种疾病的新疗法正在迅速出现,但由于两者都是相对罕见的疾病,因此目前缺乏临床试验数据。草酸中毒和高草酸尿症基金会 (OHF) 内的一个工作组,与肾脏健康倡议 (KHI) 合作,于 2017 年成立,以确定可能的试验终点,目的是扩大肠道高草酸尿症的治疗选择。作为该过程的第一步,一个多学科工作组对有关肠道高草酸尿症的病理生理学和当前治疗方案的文献进行了系统回顾;本文件是对这一初步努力的总结。
肠道高草酸尿症的病理生理学
草酸盐来自多种饮食和内源性来源,是人体新陈代谢的最终产物。虽然在正常情况下一小部分摄入的草酸盐被吸收(通常为 5%–10%),但大部分尿液草酸盐来自内源性肝脏产生 (1,2)。任何从饮食中吸收或内源性产生的草酸盐都会被输送到肾脏,在那里它被自由过滤并以尿草酸盐的形式排出体外 (3)。胃肠道草酸吸收或肝草酸生成增加会增加血浆草酸,从而增加尿草酸,并增加结石形成和其他肾脏不良后果的风险,例如肾钙质沉着症。图1) ( 4 )。
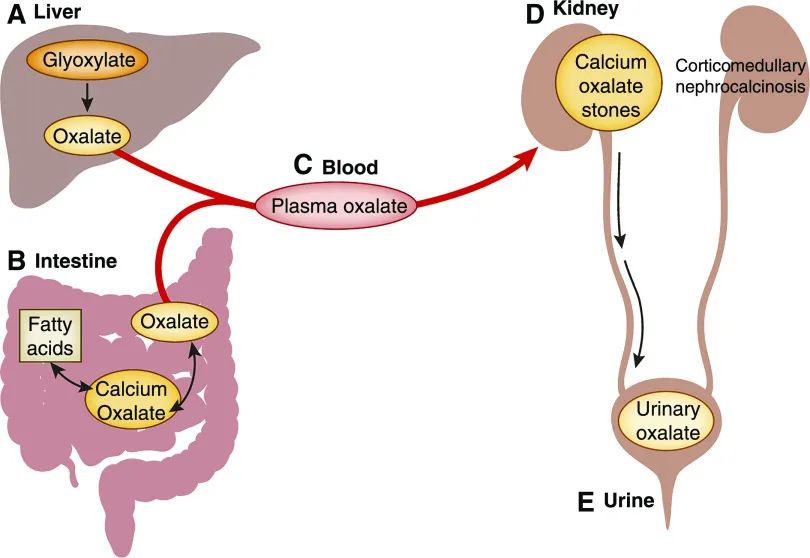
图1尿草酸盐来源于肠道高草酸尿症中肝脏代谢和胃肠道吸收的组合。
(A) 草酸盐是乙醛酸盐在肝脏代谢的终产物。系统性草酸盐的剩余部分来自摄入某些水果和蔬菜。这些植物中的草酸盐是相对不溶的草酸钙晶体形式。因此,在正常情况下,只有 5%~10% 的草酸盐被吸收,其余的进入粪便。然而,在任何原因的脂肪吸收不良(肠道高草酸尿症)患者中,未消化的脂肪酸会到达大肠,在那里它们可以与钙结合;(B) 净效应是将更多的游离草酸盐释放到肠腔中。据认为,这种游离草酸盐在大肠中大部分被细胞旁吸收。由于脂肪吸收不良,在肠道高草酸尿症患者中,最终被吸收的摄入草酸盐的净百分比可以增加到≥30%。任何来自肝脏或从饮食中吸收的草酸盐都由 (C) 血液输送到 (D) 肾脏,并从那里排出通过肾小球滤过和近端肾小管分泌的组合。草酸向肾脏的输送增加导致(E)尿草酸排泄增加,这反过来又使这些患者面临草酸钙肾结石、皮质髓质肾钙质沉着症和草酸肾病的风险。
肠道高草酸尿症可能是由于膳食草酸盐的生物利用度增加或胃肠道草酸盐渗透性增加所致。在动物模型中,肠道内草酸盐分泌减少也与高草酸尿有关 (5,6 ))。膳食草酸盐的生物利用度部分取决于摄入食物中的钙含量,因为钙可以在肠腔中形成不溶性草酸钙盐,这些盐会随粪便排出。饮食中游离脂肪酸摄入量的增加,或它们在小肠中的吸收不良,会导致更多的脂肪输送到结肠,在那里它可以结合膳食钙,从而增加可以吸收到血液中的游离草酸盐。胆汁盐和脂肪酸不仅决定了肠道中可溶性草酸盐的生物利用度,它们还可以增加肠道中的局部膜通透性,从而促进草酸盐的吸收 (7)。因此,任何原因引起的脂肪吸收不良的净效应是增加了腔内草酸盐吸收到血液中。草酸盐稳态可能会受到肠道微生物群和遗传异常的影响。过去 20 年的研究已经确定了肠道微生物组在草酸盐稳态中的作用 (8,9)。某些细菌菌株,包括草酸杆菌属、双歧杆菌属和乳酸杆菌属,可以降解草酸盐并可能能够调节肠道草酸盐分泌 (6,10)。此外,动物研究表明,阴离子交换剂 SLC6 家族的遗传缺陷可能导致肠道高草酸尿症 (11,12)。然而,两者在人类疾病中的作用仍有待确定。
肠源性高草酸尿症中的原因
肠道高草酸尿症经常与影响脂肪吸收的消化系统疾病(如克罗恩病、囊性纤维化、慢性胆道疾病、胰腺病变和短肠综合征)一起观察到 (13)。与脂肪吸收不良相关的慢性腹泻可能导致尿量减少、低柠檬酸尿和低镁尿,这进一步增加了结石形成的风险。
用于减肥的外科手术与肠道高草酸尿症和由于脂肪吸收改变导致的更高结石风险有关。空肠回肠搭桥手术几乎普遍与肠道高草酸尿症有关,但由于这个和其他并发症,在 1980 年代初期被放弃了 (14)。在随后的几年中,该程序在很大程度上被 Roux-en-Y 胃旁路术 (RYGB) 和胆胰分流术所取代,这也可能导致肠道高草酸尿症、草酸钙肾结石和草酸盐肾病。减肥手术的非转移性手术(即限制性),如袖状胃切除术,似乎很少引起肠道高草酸尿症,并且与肾结石风险显着增加无关(15)。在过去 10 年中,袖状胃切除术的使用有所增加,RYGB 有所减少;因此,与减肥手术相关的肠道高草酸尿症的发生率可能会随着时间的推移而下降。尽管如此,每年仍有数以万计的 RYGB 手术进行,并且在未来几十年内,之前接受 RYGB 和其他吸收不良手术治疗的高危患者数量将相当可观。最近的一项研究表明,使用可以改变肠道微生物组的抗生素 (16) 会增加肾结石的风险(17)。由于良好的观察证据支持草酸杆菌、双歧杆菌、乳酸杆菌和其他肠道微生物群在维持草酸盐稳态中的潜在作用,这种相关性是有效的,但需要更多的研究来确定这种关系的因果关系和确切的机制。
美国肠道高草酸尿症的患病率
肠道高草酸尿症及其主要并发症(肾结石和 CKD)的患病率仍然不明确。2019 年美国患有与肾衰竭和/或复发性肾结石相关的肠道疾病的患者总患病率估计为 250,000 人。最常见的原因是 RYGB 手术治疗肥胖(约 60%)、炎症性肠病(约 20%)、乳糜泻(8%)和慢性胰腺炎(4%)。
肠源性高草酸尿症中的肾结石
肾结石是一种公认的肠道高草酸尿症并发症 (18),尿中草酸盐排泄似乎与结石风险相关。在一项对 RYGB 后 762 名患者的研究中,尿草酸随着时间的推移而增加,并且在发生结石的患者中最高(结石形成者为 63 毫克/天,而非结石形成者为 42 毫克/天,P
RYGB 后 10 个月至 6 年报告的结石发病率范围为 0.02% 至 18%(表格1)。在报告了术前和非手术对照数据的研究中,术后结石发生率比术前高 7%,与肥胖和未接受手术的受试者相比高 3%–7%。最近的一项荟萃分析报告称,RYGB 合并结石形成的相对风险为 1.79(95% CI,1.54 至 2.10)(21)。在导致更明显吸收不良的手术(即,极长肢体 RYGB 或胆胰分流术)后,与非手术对照组肥胖的患者相比,患者患结石的风险高 5 倍(15)。在对 24 项研究的详细文献回顾中,总共包括 6777 名接受过减肥手术并有结石病史的患者和 7089 名非结石形成对照者,非结石形成者的结石发生率高出两倍。9%),在有结石病史的患者中高出四倍(17%)(20)。减肥手术以外的吸收不良状况也与肾结石风险相关,研究报告的结石发病率在 2% 到 38% 之间。表 2)。患有炎症性肠病和高草酸尿症的患者结石发生率为 35%,而尿草酸排泄正常的炎症性肠病患者的结石发生率为 23% (22)。在接受肠切除术的患者中,结石的发生率与切除时间长短相关 (23,24)。然而,切除的肠段很重要,因为小肠的丢失有利于脂肪吸收不良,而与肠道高草酸尿症相关的病理性草酸盐吸收主要发生在结肠中。因此,切除结肠的患者,例如溃疡性结肠炎患者,患肠道高草酸尿症的风险较低。
与没有囊性纤维化的年龄匹配的对照组(1%–2%)相比,3%–6% 的囊性纤维化患者患有肾结石。建议的机制包括脂肪吸收不良导致的高草酸尿、低柠檬酸尿、抗生素暴露和缺乏产酸草酸杆菌定植 (25)。最近,在囊性纤维化小鼠模型中, 表达和 介导的肠道草酸盐分泌存在缺陷,并且与尿草酸盐排泄和血浆草酸盐浓度增加 2.5 倍有关 (26 )。
其他肾脏并发症和病史
越来越明显的是,尿草酸盐是其他肾脏疾病的危险因素,包括 AKI 和 CKD (27–30)。AKI 发生在患者摄入乙二醇后,乙二醇经肝脏代谢为草酸盐,或大量食用大黄和杨桃等水果(两者都富含草酸盐)。草酸钙晶体可在肾小管内沉淀,与上皮细胞结合,引起梗阻。附着的晶体可以被吞噬并转入肾间质 (32)。由此产生的炎症介质释放可导致草酸盐肾病和肾功能进行性丧失的可能性 (33)。动物研究中的证据表明,草酸钙晶体引起的炎症可能由 NLRP3 炎性体介导,这与在痛风(尿酸)和动脉硬化(胆固醇)中观察到的晶体引起的炎症途径相同 (34)。TGF- β的刺激在高草酸尿症动物模型中,NLRP3 的释放与肾纤维化和肾功能进行性丧失有关 (35)。同样,RYGB 后患者的肾活检标本显示弥漫性肾小管退行性变化、大量肾小管草酸钙沉积和不同程度的肾小管间质瘢痕形成 (28 )。
肠道高草酸尿症中的草酸盐肾病可导致进行性肾脏恶化,最终导致需要透析的肾功能衰竭。需要进行减肥手术的肥胖综合征患者通常患有潜在的 CKD (27,38)。因此,术后高草酸尿症和肾结石形成使该人群处于肾衰竭的进一步长期风险中。胰腺功能不全的患者,如囊性纤维化,也可能因草酸盐肾病而发生肾功能衰竭,特别是如果他们不依从胰腺酶替代疗法 (39 )。当 GFR 低于每 1.73 m230–40 ml/min时,血浆草酸盐水平会升高。这反过来又可以促进草酸钙结晶和沉积在肾外组织中,这一过程称为全身性草酸中毒 (40)。在极少数情况下,患有 CKD 和严重继发性高草酸尿症的患者会出现视网膜、关节和皮肤中的全身性晶体沉积,尤其是在口服高剂量维生素 C 时,维生素 C 会代谢为草酸盐 (41 , 42 )。
患者因草酸盐肾病肾功能衰竭接受肾移植后,他们仍然面临在同种异体移植物中复发性草酸盐肾病的风险 (43)。在一份关于三名患有需要移植的肾功能衰竭的肠道高草酸尿症患者的小型报告中,两名患者出现复发性草酸盐肾病,一名需要进行第二次移植(37)。
最后,除了伴随的肾脏风险外,越来越多的证据表明高草酸尿症可能是心血管并发症发病机制的一个因素。血浆草酸盐升高与反应性心脏纤维化、血管钙化增加以及脉搏波速度降低和中心主动脉血压降低等血流动力学影响有关 (44–47)。因此,肠道高草酸尿症的影响可能远远超出结石。
目前的疗法
肠道高草酸尿症没有特定的治疗方法。目前的管理包括治疗潜在疾病,以减少脂肪吸收不良。因为这并不总是可能或充分的,所以需要采取措施减少草酸盐的胃肠道吸收(以及因此其通过肾脏的排泄)和/或减少尿液和肾小管液中草酸钙结晶的措施。例子包括减少脂肪或草酸盐的饮食消耗,使用钙补充剂结合肠道中的草酸盐,以及增加每日液体摄入量以降低草酸钙浓度。最后,还研究了其他治疗方法,例如胆汁酸或胆汁酸螯合剂、益生菌、草酸盐降解酶和钙补充剂。
基础疾病的治疗
只要有可能,治疗潜在的胃肠道疾病对于减少脂肪吸收不良和由此产生的肠道高草酸尿症至关重要。在过去 3 年中,有大量病态肥胖患者接受了吸收不良的减肥手术,并且有发生严重高草酸尿症和肾功能衰竭的风险 (29,48)。如果发生草酸盐肾病,逆转旁路可能会改善肾功能并减少草酸盐排泄,尽管逆转可能会带来重大风险并且很少进行 (49 , 50)。
在患有乳糜泻的患者中,与控制水平相当的无麸质饮食治疗可降低结石发病率 (51)。在胰腺功能不全的患者中,例如继发于囊性纤维化的患者,持续使用胰酶疗法可减少脂肪泻,因此可以防止结石形成 (52)。在炎症性肠病中,肠道高草酸尿症可以通过药物治疗来降低疾病活动度,并尽可能避免手术切除小肠 (53 )。
饮食措施
增加液体摄入量是一种通用的结石预防工具,是肠道高草酸尿症治疗的标准组成部分。然而,肠道高草酸尿症患者可能有肠道短或腹泻,这限制了他们可以耐受的液体摄入量。低草酸盐饮食是一种明显的治疗策略 ( 50 , 54 )。尽管使用低草酸盐饮食(
其他方法
使用天然的结合胆汁酸可能会使那些已知胆汁酸缺乏的显着回肠末端切除患者受益,尽管这种方法缺乏明确的证据 ( 65 )。较早的研究表明,使用胆汁酸螯合剂(例如消胆胺)在减少肠道高草酸尿症中的尿草酸盐排泄方面具有不同的功效(66– 69)。 使用草酸脱羧酶的口服制剂在胃肠道中酶促降解草酸是一种较新的潜在治疗策略 ( 70)。一项针对 16 名特发性和肠道高草酸尿症参与者的 2 期开放标签试验发现,口服草酸脱羧酶 4 天后,尿草酸排泄量减少了 14 mg/d,而在肠道(-22.0 mg/d)患者中观察到的减少幅度更大。) 与特发性 (-10.2 mg/d) 高草酸尿症 ( 71 )。近期完成了一项针对肠道高草酸尿症患者治疗28天的3期随机对照试验,后续的3期随机对照试验将评估口服草酸脱羧酶对肠道高草酸尿症患者结石复发的影响())。未来的研究可能会确定在结肠和小肠中操纵草酸盐转运的方法,但仍有许多工作要更好地了解这些途径(72– 74)。 去:
未来方向
尽管在过去 50 年中关于从胃肠道吸收草酸盐的知识已经了解很多,但仍然存在许多差距。总体而言,文献有限,大多数临床研究都是小型、单中心和非随机的。此外,没有明确的证据表明减少尿草酸盐会减少结石形成或保留肾功能,尽管已知的病理生理机制表明这应该是有益的。肠道高草酸尿症也有许多不同的潜在病因,对照试验有限。因此,现有肠道高草酸尿症治疗的数据存在显着差距,未来的研究应旨在将更多人群纳入随机对照试验。
肠道草酸盐转运机制
在过去的 20 年中,草酸盐转运蛋白的分子鉴定取得了重大进展。一些研究人员已经证实 蛋白可以在肠细胞的顶膜主动分泌草酸盐,在动物模型中 的缺失会导致高草酸尿症和草酸盐肾结石 (11,12)。与 类似,非洲爪蟾卵母细胞中的功能表达表明 可以介导草酸盐转运 (75,76)。此外, 基因敲除小鼠的一个品系出现了与 基因敲除小鼠类似的高草酸血症、高草酸尿症和草酸钙肾结石 (77),而另一种品系则没有 (78)。也有人提出通过 ( 79 ) 在顶膜发生主动的跨细胞草酸盐吸收。然而,异源表达研究表明人 的草酸盐亲和力较差(80),基因敲除小鼠的尿草酸盐排泄量较低可能是由于这些小鼠表现出的腹泻,而不是跨细胞草酸盐吸收减少。总体而言,迄今为止,人类肠道中草酸盐转运的确切分子机制仍未完全了解。需要进一步的研究来确定草酸转运蛋白的分子特性和生理功能以及它们在人类肠道高草酸尿症中的重要性。
肠道微生物组在草酸盐代谢和运输中的潜在作用
过去 2 年的工作已将O. 确定为一种专性厌氧菌,可降解草酸盐并刺激肠道中的草酸盐吸收 ( 5 , 81 )。然而,在原发性高草酸尿症患者的临床试验中,使用O. 作为人类治疗剂并没有降低尿中草酸排泄或血浆草酸浓度( 5),并且尚未在肠道高草酸尿症患者中进行广泛研究。人类的定植率不一,流行病学证据表明定植与不同患者人群的肾结石风险有关。新出现的证据表明,肠道微生物组的其他元素也可能参与草酸盐降解,维持微生物组的生物多样性对于维持足够的草酸盐代谢很重要 ( 81 , 82 )。
结论
与脂肪吸收不良相关的多种胃肠道疾病可导致草酸盐过度吸收并导致肠道高草酸尿症。这种疾病最常见于短肠综合征和吸收不良减肥手术后(最常见的是 RYGB),但也可能发生在炎症性肠病和任何原因的胰腺功能不全中。肠道高草酸尿症与肾结石的高风险相关,而 CKD 的风险则较少。然而,很少有已发表的文献提出统一有效的措施来减轻肠源性草酸尿症的后果。显然,需要更多的研究和新的治疗方法,以及对临床试验的适当终点进行仔细分析。
上一篇:中考语文现代文阅读解题方法归类
下一篇:解析最全面的民间去痘偏方
发表评论